植物RNA的提取有什么好的方法?
我在提富含多糖多酚的植物的RNA,提的效果不是很好,大家有什么好方法没
我在文献中查到了CTAB结合SDS法,这个方法如下我对其中的几个温度不太理解 请大侠们解释下吧 第二步中的提到的低温处理 起到了什么作用啊 大家也帮我看下这个方法有什么不合理的地方没?
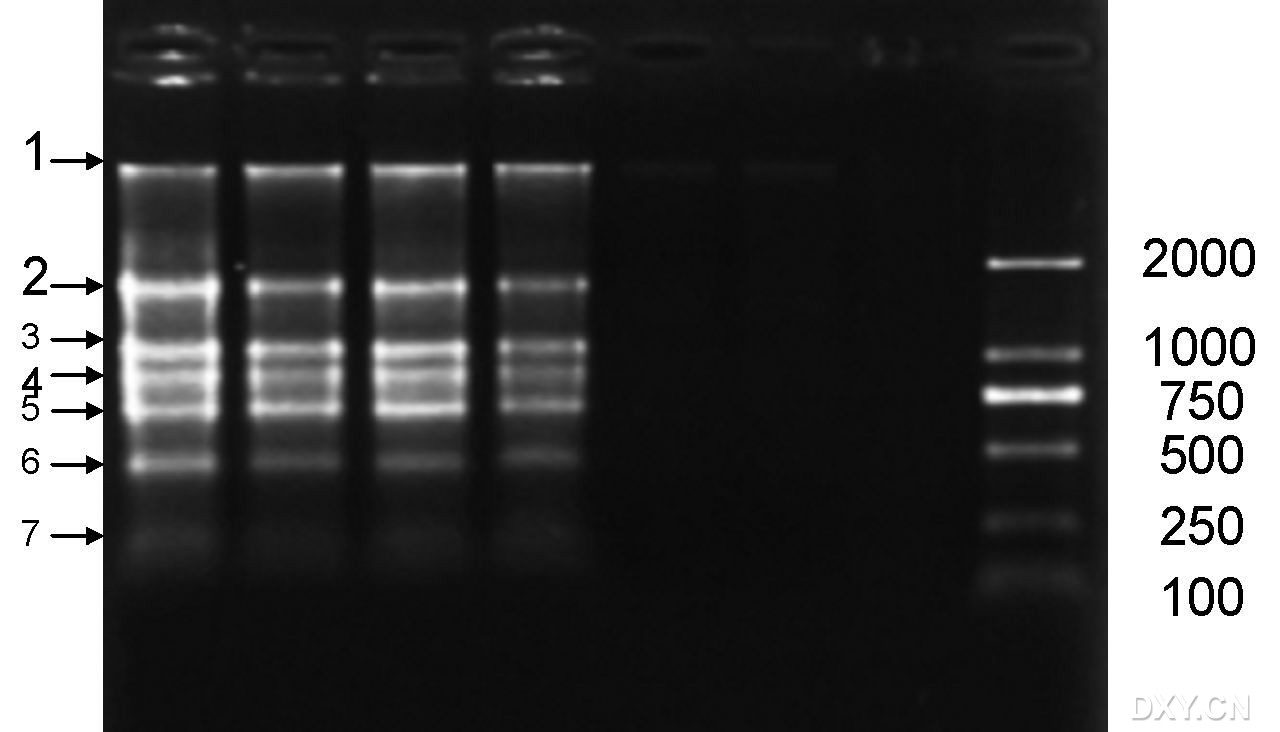
1 CTAB结合SDS法。分别称取叶片、叶柄和韧皮部各0.4 g于研钵中,加入0.05 g PVP,加入适量液氮,迅速研磨成粉末状,并将所有粉末全部转入2 mL离心管中;加入800 μL提取液(680 μL CTAB提取液、 80 μL 10%SDS、40 μL β-巯基乙醇;CTAB 提取液成分为:2%CTAB、2.5 mol/L NaCl、0.5 mol/L Tris、50 mmol/LEDTA),用力剧烈震荡使所有粉末均匀悬浮于提取液中;
2 65℃水浴20 min,期间剧烈震荡,使其充分混合,水浴后将离心管迅速放入-80℃冰箱中低温处理2 h以上;
3 取出经低温处理后的混合物,将其置于45℃水浴10 min,期间轻轻震荡,使完全溶解;
4 4℃,12000 r/min 离心30 min,将上清液转入预冷的2 mL离心管中,加入等体积酚∶氯仿∶异戊醇(25:24:1,V/V/V),在冰上用力振荡,使其充分混匀,
5 4℃,12000 r/min离心15 min(抽提2次),将上清液转入预冷过的1.5 mL离心管中,加入12 mol/L LiCl,使其终浓度为2 mol/L,冰上轻震荡充分混匀后置于-20℃条件下存放2 h以上;
6 4℃,12000 r/min 离心 10 min,去除上清液,加入 400 μL 预冷的75%的酒精清洗(重复2次);室温下干燥15 min,加 20 μL DEPC-H2O 溶 解
进 行 下 一 步 试 验 或 置于-80℃冰箱中保存备用。
65度水浴这步主要起到裂解细胞,释放出核酸的作用。在提取RNA过程中建议不要剧烈震动,适当振摇即可。
低温处理的作用主要是让核酸析出沉淀,为什么-80度我也不理解,楼主从哪里看到这个方法?
效果时好时差?做同样的样品吗?如果是同样的样品效果时好时坏那很可能就是操作的问题。
如果是不同的样品,那很正常。不同的植物所含杂质不一样,用同样的方法肯定会出现对某些植物效果好,而对某些植物效果差的情况。
多糖多酚类植物材料提RNA,我觉得主要需要添加一步抽提派出糖及酚的干扰,我手头收集的文献有建议使用70%丙酮抽提后用SDS-LiCl法提取。此外还有很多文献提出有用的建议,楼主不妨以比较可靠的经典方法做基础,参考这些文献自己摸索一下,不要盲目照着单一文献做。
我以前用的就是SDS-licl的方法 方法好像存在点问题 你关于这个方法的文献能不能发给我下 谢谢
我Zui近也在提RNA,如果除糖的话,加入KAc抽提下比较好;还有就是含酚多,那在酚、氯仿抽提后应该再用氯仿抽提,除酚的效果较好。以上意见仅供参考
一般加KAC后,是要冰浴吗
请问楼主的Zui后的室温干燥,怎么干燥的呀……
嘿嘿 教你个更加有效的干燥方法:
乙醇洗完后 倾倒掉大部分乙醇 后短暂离心 甩1-2s即可 使用100uL的移液枪套上黄枪头后再套10uL系列白枪头(这样主要是底下剩余的液体绝对比10uL多 但黄枪头开口大移液时肯定移不干净 同时可能粘乙醇到壁上) 需要用力攥紧(这里需要点技巧)这时候吸取底部残余乙醇 不用2分钟基本就能干透 避免了RNA长时间暴漏于空气中
我基本上8个样品的话 吸掉Zui后一个样品的乙醇时第一个已经干透了
:)
嘿嘿 教你个更加有效的干燥方法:
乙醇洗完后 倾倒掉大部分乙醇 后短暂离心 甩1-2s即可 使用100uL的移液枪套上黄枪头后再套10uL系列白枪头(这样主要是底下剩余的液体绝对比
CTAB法
哦 是这样 我以前是用SDS-licl 提的 效果不好主要是指 一次实验中有的样品还可以 有的却很差 有的时好有的时候很差 所以想试下别的方法...