癌细胞的铁成瘾可能是致命弱点
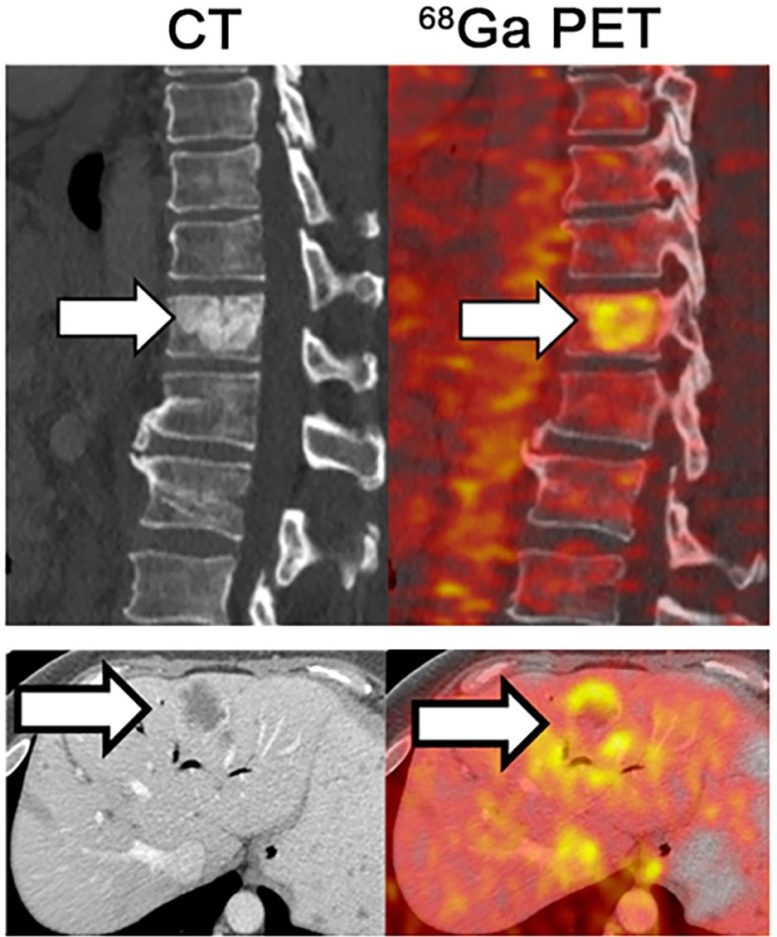
PET 成像(右)显示在胰腺导管腺癌患者的脊柱和肝脏中生长的转移性肿瘤中铁的积累。图片来源:© 2022 蒋等人。最初发表在《实验医学杂志》上。https://doi.org/10.1084/jem.20210739
加利福尼亚大学旧金山分校 (UCSF) 的研究人员发现,携带人类癌症中发现的最常见突变的细胞会积累大量的亚铁,这种“铁吸附”可以被利用来专门提供强大的抗癌药物,而不会伤害正常人。 ,健康的细胞。该治疗策略在 2022 年 3 月 9 日发表在《实验医学杂志》 ( JEM ) 上的一项研究中进行了描述,可用于治疗由KRAS基因突变驱动的多种癌症。
KRAS突变存在于许多癌症中,尤其常见于胰腺导管腺癌 (PDA)、结直肠癌、急性髓性白血病和肺腺癌。总的来说,KRAS突变被认为是通过激活驱动细胞增殖和增强细胞存活的细胞信号通路导致四分之一的癌症死亡。这些信号通路可以被抑制 KRAS 激活的某些蛋白质的药物阻断,但是,除了杀死癌细胞外,这些药物对健康细胞和组织具有高毒性,限制了它们在抑制癌细胞信号传导所需的剂量下的使用.
“例如,MEK1/2 酶抑制剂已显示出临床益处,但该方法在眼睛、皮肤、肠道和其他器官中存在剂量限制性毒性,”医学博士、医学博士 Eric A. Collisson 解释说。加州大学旧金山分校医学系。“临床经验表明,这些抑制剂的可持续剂量通常远低于 FDA 批准的剂量,严重阻碍了肿瘤细胞中可达到的剂量强度,并最终限制了临床疗效。”
在新的JEM研究中,第一作者 Honglin Jiang 及其同事开发了一种方法,将 MEK 抑制剂和可能的其他抗癌剂靶向KRAS驱动的肿瘤,而不会伤害体内其他健康组织。
研究人员发现,多种KRAS驱动的肿瘤显示出与铁摄取和代谢有关的基因活性增加,并且在 PDA 中,这种基因活性的增加与较短的存活时间相关。PDA 患者的 PET 扫描显示他们的肿瘤积累了高水平的铁。江和他的同事们想知道,这种对铁的依赖是否可以提供一种更精确地靶向这些癌细胞的方法。
“我们发现铁水平升高,特别是在其亚铁、Fe 2+氧化态,是由致癌KRAS驱动的,因此我们假设突变的KRAS驱动的 PDA 肿瘤细胞可能被亚铁激活的药物偶联物选择性靶向(FeADC),”领导这项研究的加州大学旧金山分校药物化学系教授 Adam R. Renslo 解释道。
FeADC 是药物的非活性版本,在 Fe 2+存在下会分解,释放出药物的活性版本。该方法的灵感来自于青蒿素等抗疟疾药物,该药物靶向寄生虫中的 Fe 2+,因为它侵入红细胞并降解血红蛋白,产生大量游离血红素铁。
相关推荐:南京哪里可以做冷冻干燥?
Renslo 和团队合成了 FDA 批准的 MEK 抑制剂 cobimetinib 的 FeADC 版本。实验室测试表明,这种名为 TRX-cobimetinib 的药物偶联物对人体皮肤或视网膜细胞几乎没有影响,但在KRAS突变癌细胞内被激活,抑制 KRAS-MEK 信号通路并阻断细胞生长。
然后,研究人员在几种不同的KRAS驱动癌症小鼠模型中测试了 TRX-cobimetinib ,包括 PDA 和肺腺癌。在每种情况下,TRX-cobimetinib 都与正常的 cobimetinib 一样抑制肿瘤生长。然而,与正常的 cobimetinib 不同,TRX-cobimetinib 对其他健康组织没有造成可检测的损害。这种毒性的缺乏使研究人员能够将 TRX-cobimetinib 治疗与其他抗癌药物结合起来。这些联合疗法在抑制肿瘤生长方面甚至更好,对其他组织几乎没有副作用。
“在这项研究中,我们描述了一种治疗策略,该策略能够针对KRAS驱动的肿瘤中的信号通路进行更耐受和更有效的联合疗法,”Collisson 说。“在KRAS驱动的癌症中发现可药理学利用的 ferroaddiction有望通过对 FeADC 设计、开发和临床测试的实用和可推广的方法来改善致命癌症的治疗。”
